A6 - Glycotoxine in Lebensmitteln
Projektleiter: Prof. Dr. C. Kunz/ Prof. Dr. R.G. Bretzel
Mitarbeiter: MSc. J. Ehl
Advanced glycation endproducts (AGEs) werden im Rahmen der Maillardreaktion durch nicht-enzymatische Glykierung von Proteinen gebildet. Bei diesen Prozessen entstehen des Weiteren reaktive Carbonylverbindungen wie Glyoxal und Methylglyoxal und führen gleichzeitig zu weiteren Glykierungsschritten. Maillardreaktionsprodukte entstehen nicht nur endogen, sondern auch im Rahmen von Erhitzungsprozessen in Lebensmitteln. Diese werden synonym auch als Glycotoxine bezeichnet, da sie möglicherweise ähnliche pathologische Effekte haben wie endogen gebildete AGEs. Die Carbonylverbindungen Glyoxal und Methylglyoxal, sowie AGEs sind u.a. mit Diabetes, vaskulären Erkrankungen und mit Inflammation allgemein assoziiert. Sie beeinflussen die Signaltransduktion verschiedener Zellen u.a. über die Interaktion mit RAGE (receptor for advanced glycation endproducts). Die Aktivierung von RAGE führt zu einem Anstieg an intrazellulärem oxidativen Stress sowie zu einer Aktivierung des Nukleären Transkriptionsfaktors NF-kB. Da oxidativer Stress nicht nur durch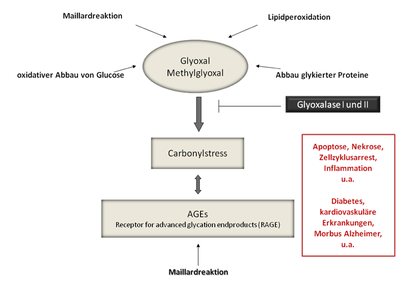
Bisherige Ergebnisse:
Die Carbonylverbindungen Glyoxal und Methylglyoxal sind sehr reaktiv und führen an Proteinen im Rahmen der Maillard Reaktion zu nicht-enzymatischen Glykierungen. Im weiteren Verlauf dieser Reaktionen werden u.a. stabile advanced glycation endproducts (AGEs) gebildet. Wir konnten zeigen, dass sowohl die Carbonylverbindungen Glyoxal und Methylglyoxal, als auch in vitro hergestellte AGEs die Sekretion proinflammatorischer Cytokine in intestinalen Zellen steigern. AGEs beeinflussen die zelluläre Signaltransduktion u.a. über Interaktion mit dem Rezeptor für AGEs (RAGE). Wir konnten mittels Westernblot-Analyse und Reverse-Transkriptase PCR bestätigen, dass Caco-2 Zellen RAGE exprimieren. Eine Interaktion von AGEs aus Lebensmitteln mit RAGE im Dünndarm ist folglich wahrscheinlich. Derzeit werden weitere mögliche Effekte und zugrunde liegende Signaltransduktionsmechanismen untersucht
Eine Humanstudie zur Untersuchung der Bioverfügbarkeit und Metabolisierung von AGEs ist in Vorbereitung.
Posterpräsentationen
Ehl JM, Kuntz S, Rudloff S, Bretzel RG, Kunz C: „Proinflammatory effects of food derived advanced glycation endproducts in intestinal cells”, COST 927 ACTION: Thermally processed foods: possible health implications, Sofia, Bulgaria, May 2007
Ehl JM, Kuntz S, Rudloff S, Bretzel RG, Kunz C: „Effects of food derived carbonyl compounds on proinflammatory cytokines in intestinal cells”, 9th International Symposium on the Maillard Reaction, Munich, Germany, September 2007
Vorträge
Ehl JM, Borsch C, Rudlofff S, Kuntz S, Linn T, Bretzel RG, Kunz C: “Glycotoxine in Lebensmitteln“, Seminartag “Mensch, Ernährung, Umwelt”, Giessen, Oktober 2005
Ehl JM, Kuntz S, Bretzel R.-G., Kunz C: „Glycotoxine in Lebensmitteln“ Seminartag „Mensch, Ernährung, Umwelt“, Giessen, Dezember 2006
MEU-Vernetzung und externe Kooperationen:
Vernetzung mit der „MEU-Methodenplattform Stabile Isotope und Zellbiologie“
Dieses Projekt wird von Julia M. Ehl im Rahmen ihrer Dissertation mit dem Thema:“ Bioverfügbarkeit, Metabolisierung und Funktionen von Glycotoxinen aus Lebensmitteln beim Menschen“ bearbeitet.
Weitere Informationen:
Institut für Ernährungswissenschaften
Medizinische Klinik und Poliklinik III
