Forschung
Prof. Dr. Klaudia Giehl
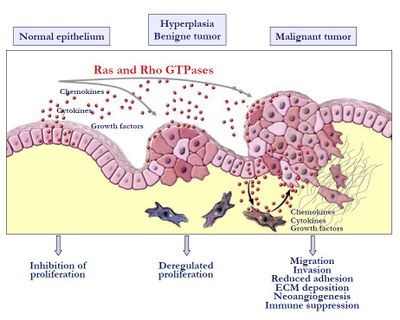
Monomere GTPasen fungieren als zentrale binäre molekulare Schalter in der Transduktion von extrazellulären Signalen von der Plasmamembran ins Zellinnere. Dysregulationen der Aktivitäten dieser GTPasen sind ursächlich mit zahlreichen Erkrankungen und Störungen in zellulären und strukturellen Prozessen verbunden. So treten aktivierende Mutationen in ras-Genen in 30 % aller humanen Tumore auf. Die Mutationen sind dabei gewebs- und tumorspezifisch und betreffen in der Regel nur ein ras-Gen, wobei K-ras mit 90 % in Pankreaskarzinomen, 50 % in Kolonkarzinomen und 30-50 % in Lungenadenokarzinomen die höchste Mutationsrate aufweist. Eine Überexpression weiterer GTPasen, insbesondere von Rho-GTPasen, ist charakteristisch für zahlreiche maligne Karzinome.
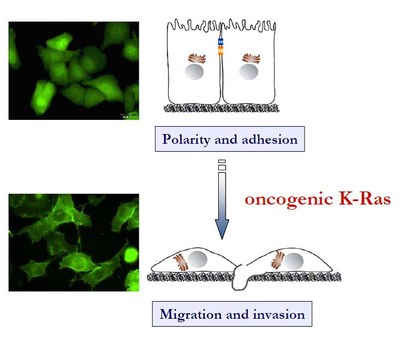
Schwerpunkt der Arbeiten der Gruppe ist die Identifizierung der isoformspezifischen Funktion(en) von Ras-Proteinen und die Charakterisierung der Interaktion und Funktion von Ras- und Rho-Proteinen sowie deren Regulatoren und Effektoren an tumorbiologisch relevanten Prozessen. Hierzu zählen insbesondere die Migration und Invasion von Karzinomzellen, die epithelial-mesenchymale Transition (EMT) sowie die Aktinzytoskelett-Reorganisation. Mit Hilfe biochemischer, molekular- und zellbiologischer Methoden wird die Spezifität und Dynamik Ras- und Rho-GTPase-regulierter Signalprozesse untersucht und in den Kontext der zellulären und pathophysiologischen Signalverarbeitung gestellt. Durch die gewonnenen Erkenntnisse soll ein substanzieller Beitrag zum Verständnis der zellulären Bedeutung onkogener Ras- und Rho-Isoformen in der Tumorinduktion und -progression geleistet werden.
Die aktuellen Projekte umfassen folgende Fragestellungen:
- Identifizierung von neuen Akt-Effektoren in der K-Ras-induzierten Migration und Invasion von Karzinomzellen
Trotz stark verbesserter Tumortherapieansätze ist die Aufklärung der molekularen Ursachen der Metastasierung eine zentrale Herausforderung für die moderne Tumorforschung, die dringend weitere grundlagenorientierte Forschungsarbeiten notwendig macht. Wichtig sind die detaillierte Charakterisierung einzelner Proteine und Signalwege in der Metastasierung und die Entwicklung neuer therapeutischer Ansatzpunkte in der Behandlung metastasierender Tumore. Ziel dieses Projektes ist es, den Beitrag und die molekularen Mechanismen der K-Ras/Akt-induzierten Migration von Tumorzellen durch Charakterisierung von neuen Akt-Effektorproteinen aufzuklären.
(Kooperationsprojekt mit Prof. Dr. Robert Grosse, Pharmakologisches Institut, Philipps-Universität Marburg, UKGM Forschungsförderung)
- Regulation der K-Ras-induzierten Signaltransduktion und Motilität durch Galektine
Mutierte K-Ras-Proteine sind wichtige prädiktive und prognostische Biomarker für Tumorerkrankungen. Ein wichtiger Ansatzpunkt in der Entwicklung neuer therapeutischer anti-Ras Strategien ist die Inhibition der Interaktion von Ras mit der Membran und mit direkten Targetproteinen. Im Rahmen unserer Arbeiten wird die funktionelle Bedeutung von Galektinen als Interaktionspartner für K-Ras für die Tumorprogression und Metastasierung von Pankreas- und Lungenkarzinomen untersucht werden. Neben der molekularen Charakterisierung der Interaktion von onkogenem K-Ras mit Galektinen und den funktionellen Auswirkungen auf Signaltransduktionsprozesse und physiologische/pathophysiologische zelluläre Eigenschaften, soll geklärt werden, ob diese Interaktion einen neuen therapeutischen Ansatzpunkt in der Therapie von Tumoren mit K-Ras-Mutation darstellt.
(Kooperation mit Frau Prof. Dr. Katja Becker, Institut für Ernährungswissenschaften – AG Biochemie und Molekularbiologie, JLU Giessen)
- Charakterisierung des Einflusses von Rac-Proteinen auf die Tumorzellmotilität
Aufgrund der erheblichen Bedeutung der Familie der Rho-GTPasen für die Tumormetastasierung, werden Mechanismen der Regulation und der molekularen Vernetzung GTPase-vermittelter Signaltransduktionsprozesse aufgeklärt und in den Kontext der biologischen Signalverarbeitung in der Tumorpathogenese und Motilität gestellt. In Zusammenarbeit mit Prof. Dr. Hendrik Ungefroren, Universitätsklinikum Schleswig-Holstein, konnten wir kürzlich zeigen, dass die Rho-GTPasen Rac1 und Rac1b antagonistische Effekte in der Regulation der Zellmotilität von Karzinomzellen haben. Die hier zugrundeliegenden molekularen Mechanismen werden in weiterführenden Forschungsarbeiten analysiert.
- Charakterisierung von Smad4-unabhängigen Signaltransduktionswegen in der TGFβ-induzierten epithelialen Transdifferenzierung
Genexpressionsprofile und Signaltransduktionsstudien belegen die Interaktion von Ras mit TGFβ-induzierten Signalwegen in der epithelial-mesenchymalen Transition epithelialer Tumorzellen. Darüber hinaus konnten neue, Smad-4-unabhängige TGFβ-induzierte Signalwege in Karzinomzellen charakterisiert werden, die in weiteren Forschungsarbeiten zur Charakterisierung von Smad4-unabhängigen Signaltransduktionswegen in der TGFβ-induzierten epithelialen Transdifferenzierung und Reduktion der Zelladhäsion fortgesetzt werden sollen.
(Kooperation mit Prof. Dr. Andre Menke, Molekulare Onkologie solider Tumore, JLU Giessen)
- Förderung
Die Forschungsarbeiten wurden durch den Verein zur Förderung der Krebsforschung in Gießen e. V. durch die Anschaffung einer Klimakammer für eine Live-Cell-Imaging Anlage unterstützt. Weitere Förderung erfolgt durch das LOEWE-Zentrum Universities of Gießen and Marburg Lung Centre (UGMLC) und durch die UKGM-Forschungsförderung gem. §2 Abs. 3 Kooperationsvertrag.
