Funktionale Charakterisierung Ovar-präferentiell oder spezifisch exprimierter Gene in Schistosoma mansoni
Ein Ziel der Grundlagenforschung an Schistosomen ist, die Regulationsmechanismen der Entwicklung dieses Parasiten zu verstehen, einschließlich der ungewöhnlichen Reproduktions-biologie. Ein besonderes Merkmal der Schistosomenbiologie ist die Abhängigkeit der Induktion und die Aufrechterhaltung der Gonadendifferenzierung der Weibchen von einem ständigen Paarungskontakt mit dem Männchen. Dieser ist eine der Voraussetzungen für die Eiproduktion. Des Weiteren ist die sexuelle Maturation weiblicher Schistosomen reversibel. Durch die Trennung vom Männchen stoppt die Eiproduktion des Weibchens, da die Gonaden degenerieren1, 2.
Der wissenschaftliche Schwerpunkt meines Projekts ist die außergewöhnliche Reproduktions-biologie der Schistosomen. Die Gonadendifferenzierung im gepaarten Weibchen führt sowohl zu großen morphologischen Veränderungen als auch zu erheblichen Veränderungen der Gen-expression bei beiden Geschlechtern, insbesondere beim Weibchen3,4. Dies führt schließlich zur Produktion von zusammengesetzten Eiern. Eiproduktion und Embryonalentwicklung laufen in einem komplexen Prozess ab (Abb. 1). Die Reifung von Schistosomeneiern wird anhand des Verhältnisses von Embryo und Eischalengröße in fünf Stadien eingeteilt (klassische Einteilung auf Basis des Vogel und Prata Staging-Systems)5, 6. In neueren Arbeiten konnte dieses klassische Staging-System durch neue Daten erweitert werden, die durch histologische und whole-mount Techniken generiert wurden7.
In gepaarten Schistosomen dienen Proteinkinase-Rezeptoren als wesentliche Signaltrans-duktionsmoleküle im Hinblick auf die Kontrolle von Differenzierungs- und Reproduktions-prozessen8-10. Vergleichende Transkriptomstudien adulter Schistosomen und den (isolierten) Gonaden zeigten, dass 243 (Testes) und 3600 (Ovare) Gene der Gonaden paarungsabhängig reguliert werden4. Einige identifizierte, aber bisher noch nicht charakterisierte Rezeptoren umfassen verschiedene potentielle Opsin‑, Retinoid- und Thyroidhormonrezeptoren, welche bevorzugt oder spezifisch im Ovar eines gepaarten Weibchens transkribiert werden4. Weitere Analysen des gesamten Lebenszyklus zeigten, dass viele dieser Rezeptoren im Laufe der verschiedenen Lebensstadien zum einen unterschiedliche Expression aufweisen und zum anderen in den Gonaden und/oder im Eistadium stark transkribiert werden11. Dies deutet auf eine interessante biologische Funktion hin. Um ein besseres Verständnis der Rollen dieser Rezeptoren an Entwicklungsprozessen zu erlangen, besteht das Ziel dieses Projekts darin, ausgewählte Rezeptoren funktionell zu charakterisieren. Dies soll experimentell durch knock-down-Experimente über RNAi, Inhibitorstudien, Interaktionsstudien und durch die Etablierung von knock-out-Modellen ermittelt werden.
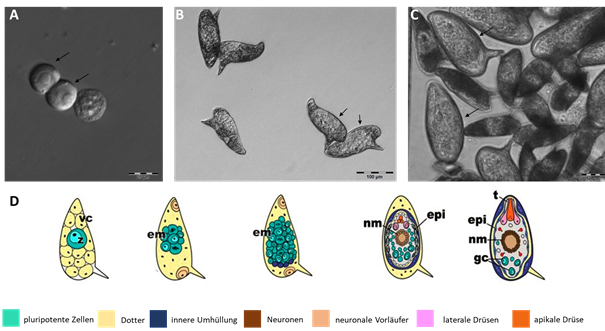 | |
|---|---|
| Abb. 1. Ei-Entwicklung von Schistosoma mansoni von der befruchteten Zygote zum maturen Embryo.3) A, befruchtete Oocyten (Zygoten), Phase-I-Eier nach der Klassifikation von Vogel und Prata, als einzelne Zellen, welche von den umgebenden Vitellinzellen getrennt wurden (Maßstab: 20 µm)5-7. B, Oocyten der Phase III, die sich durch die Größenzunahme des Embryos im Vergleich zum Ei selbst auszeichnen (Maßstab: 100 µm). C, Phase V Eier (Pfeile) nach Vogel und Prata im Vergleich zu Phase III Eiern (Maßstab: 50 µm). Eier der Phase V enthalten den maturen Embryo, der das Ei als Miracidium verlässt. Dieser Prozess wird durch Phototaxis und durch Veränderung des osmotischen Drucks der Umgebung induziert. In D sind die verschiedenen Entwicklungsstadien eines S. mansoni-Eies abgebildet, modifiziert nach Jurberg et al. 20097. Die Entwicklung des Eies, dargestellt nach Vogel und Prata, Phase I bis V (von links nach rechts). vc, Vitellinzellen; z, Zygote; em, Embryo; nm, neurale Zellen; epi, Epidermis; t, Terebratorium; gc, germinale Zellen | |
1Kunz W (2001) Schistosome male-female interaction: induction of germ-cell differentiation. Trends Parasitol. 17(5):227-31
2Grevelding CG (2004) Schistosoma. Curr Biol. 24;14(14):RS545
3Grevelding CG, Sommer G, Kunz W (1997) Female-specific gene expression in Schistosoma mansoni is regulated by pairing. Parasitology. 115 (Pt 6):635-4
4Lu Z, Sessler F, Holroyd N, Hahnel S, Quack T, Berriman M, Grevelding CG (2016) Schistosome sex matters: a deep view into gonadspecific and pairing-dependent transcriptomes reveals a complex gender interplay. Sci Rep. 6, S. 31150
5Vogel H (1942) Über Entwicklung, Lebensdauer und Tod der Eier vom Bilharzia japonica im Wirtsgewebe. Dtsch Tropenmed Ztsch. 46:57–91
6Prata A (1957) Biópsia retal na esquistossomose mansoni — bases e aplicações no diagnóstico e tratamento. Serviço Nacional de Educação Sanitária-Ministério da Saúde, Rio de Janeiro
7Jurberg AD, Goncalves T, Costa TA, de Mattos AC, Pascarelli BM, de Manso PP, Riberio-Alves M, Pelajo-Machado M, Peralta JM, Coelho PM, Lenzi HL (2009) The embryonic development of Schistosoma mansoni eggs: proposal for a new staging system. Dev Genes Evol. 219(5):219-34
8Beckmann S, Buro C, Dissous C, Hirzmann J, Grevelding CG (2010) The Syk kinase SmTK4 of Schistosoma mansoni is involved in the regulation of spermatogenesis and oogenesis. PLoS Pathog. 6 (2), e1000769
9Gelmedin V, Morel M, Hahnel S, Cailliau K, Dissous C, Grevelding CG (2017) Evidence for integrin - venus kinase receptor 1 alliance in the ovary of Schistosoma mansoni females controlling cell survival. PLoS Pathog. 23;13(1):e1006147
10Morel M, Vanderstraete M, Hahnel S, Grevelding CG, Dissous C. (2014) Receptor tyrosine kinases and schistosome reproduction: new targets for chemotherapy. Front Genet. 18;5:238
11Lu Z, Zhang Y, Berriman M (2018) A web portal for gene expression across all life stages of Schistosoma mansoni. BioRxiv. 308213
