PGM
Aktivierung der Phosphoglyceromutase in Tumorzellen
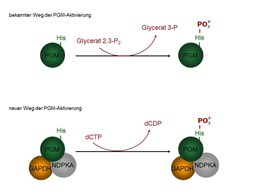
In den Biochemie-Büchern ist der Aktivierungsmechanismus der Phosphoglyceromutase (PGM) durch Glycerat 2,3-P2 beschrieben.
Für die Aktivierung wird ein Phosphat des Glycerat 2,3-P2 auf Histidin 10 der PGM übertragen. In Übereinstimmung mit dieser wichtigen Funktion von Glycerat 2,3-P2 sind in ausdifferenzierten Zellen die Glycerat 2,3-P2-Spiegel hoch (Abb. 1).
Aus diesem Grund ist es sehr überraschend, dass der Metabolit in Tumorzellen nicht nachgewiesen werden konnte. Danach dürfte die Glycolyse in Tumorzellen aufgrund des Mangels an Glycerat 2,3-P2 nicht aktiv sein. Tatsächlich sind jedoch Tumorzellen diejenigen Zellen mit den höchsten Glycolyseraten.
Wir konnten zeigen, dass die PGM durch das Enzym Nukleosiddiphosphat-Kinase Typ A (NDPK Typ A, alias nm23-H1) phosphoryliert und aktiviert werden kann, wenn sie mit der NDPKA und einem weiteren Glycolyse-Enzym, der Glycerinaldehyd 3-P-Dehydrogenase (GAPDH), in einem Enzym-Komplex assoziiert ist (Abb. 1 unten). Dabei stammt das Phosphat von Nukleotidtriphosphaten, wie z.B. dCTP. Die von uns gezeigte alternative PGM-Aktivierung ermöglicht den Zellen eine optimale Koordinierung der Nukleinsäure-Syntheserate mit den Durchsatzraten in der Glycolyse.
Unsere Untersuchungen ergaben weiterhin, dass die Assoziation zwischen der PGM, NDPKA und GAPDH die Interaktion zwischen der Glycolyse und dem Stoffwechsel der Aminosäuren Serin, Alanin und Glutamin (Glutaminolyse) reguliert.
Ein Antennapedia-Peptid (Ant-PGM), an das die für die Aktivierung relevante Aminosäure-Sequenz der PGM (LIRGHE) gekoppelt ist, hemmt den Phosphattransfer von der NDPKA zur PGM und die Zellproliferation bei einer Vielzahl von Tumorzelllinien (Abb. 2a u. 2b siehe unten).
In MCF-7 Zellen (humane Brustkrebszelllinie) war die Hemmung der Zellproliferation durch das Ant-PGM-Peptid vom Pyruvatgehalt des Nährmediums abhängig. Nur in Pyruvat-freiem Nährmedium hemmte das Ant-PGM-Peptid die Zellproliferation. In Pyruvat-haltigem Nährmedium hatte das Peptid keinen Einfluss auf die Teilungsrate der Zellen. Der Pyruvat-Effekt kann wie folgt erklärt werden: Sowohl in An- als auch in Abwesenheit von Pyruvat wird in den Ant-PGM-behandelten MCF-7 Zellen aufgrund der Hemmung der PGM die Glucose zu Serin umgesetzt. Nur in Gegenwart von Pyruvat im Nährmedium kann die Aminogruppe von Serin auf Pyruvat übertragen werden und das Kohlenstoffgerüst von Serin als Glycerat 2-P wieder in die Glycolyse eingeschleust und Energie-produzierend zu Lactat abgebaut werden.
Kooperationspartner: Dr. Matthias Engel, Universität des Saarlandes
