AG Lochnit - RNA-Interferenz (RNAi)
RNAi hat sich bei einer Vielzahl von Organismen, von Hefe über Pflanzen bis hin zu Tieren, als wirksam erwiesen, wenn es darum geht, die mRNA-Spiegel der Zielgene zu senken.
Lange doppelsträngige RNA-Moleküle (dsRNA) werden von einem RnaseIII-ähnlichen Enzym namens Dicer in 20-25 Nukleotide umfassende kleine interferierende RNAS (siRNAs) und in einen so genannten RNA-induzierten Silencing-Komplex (RISC) zerschnitten. Dieser Komplex interagiert mit der Ziel-RNA, deren Sequenz komplementär zur siRNA ist, und zerstört sie. Alternativ kann die siRNA auch als Primer für eine RNA-abhängige RNA-Polymerase (RdRP) dienen, wodurch viele weitere siRNAs entstehen.
In C. elegans wurde RNAi erstmals als Stilllegung eines endogenen Gens beobachtet, das homolog zur injizierten dsRNA ist.
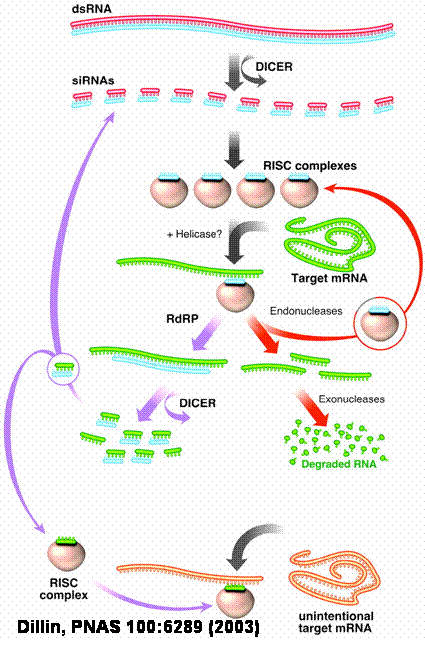
Bildrechte: privat
Literatur:
1. Zamore, P.D. and N. Aronin, siRNAs knock down hepatitis. Nat Med, 2003. 9(3): p. 266-7.
2. Yokota, T., et al., Inhibition of intracellular hepatitis C virus replication by synthetic and vector-derived small interfering RNAs. EMBO Rep, 2003. 4(6): p. 602-8.
3. Wang, Q.C., Q.H. Nie, and Z.H. Feng, RNA interference: Antiviral weapon and beyond. World J Gastroenterol, 2003. 9(8): p. 1657-61.
4. Van Houdt, H., A. Bleys, and A. Depicker, RNA target sequences promote spreading of RNA silencing. Plant Physiol, 2003. 131(1): p. 245-53.
5. Szweykowska-Kulinska, Z., A. Jarmolowski, and M. Figlerowicz, RNA interference and its role in the regulation of eucaryotic gene expression. Acta Biochim Pol, 2003. 50(1): p. 217-29.
6. Somasundaram, K., Stable RNA interference (RNAi) in mammalian cells. Cancer Biol Ther, 2003. 2(2): p. 211-2.
7. Scherr, M., M.A. Morgan, and M. Eder, Gene silencing mediated by small interfering RNAs in mammalian cells. Curr Med Chem, 2003. 10(3): p. 245-56.
8. Kawasaki, H., et al., siRNAs generated by recombinant human Dicer induce specific and significant but target site-independent gene silencing in human cells. Nucleic Acids Res, 2003. 31(3): p. 981-7.
9. Kamath, R.S. and J. Ahringer, Genome-wide RNAi screening in Caenorhabditis elegans. Methods, 2003. 30(4): p. 313-21.
10. Doench, J.G., C.P. Petersen, and P.A. Sharp, siRNAs can function as miRNAs. Genes Dev, 2003. 17(4): p. 438-42.
11. Denli, A.M. and G.J. Hannon, RNAi: an ever-growing puzzle. Trends Biochem Sci, 2003. 28(4): p. 196-201.
12. Ashrafi, K., et al., Genome-wide RNAi analysis of Caenorhabditis elegans fat regulatory genes. Nature, 2003. 421(6920): p. 268-72.
13. Alder, M.N., et al., Gene silencing in Caenorhabditis elegans by transitive RNA interference. Rna, 2003. 9(1): p. 25-32.
