Zellproliferation
Die wachstumsinhibierende oder -stimulierende Wirkung von verschiedenen Effektoren und Substraten an Zelllinien kann mit Hilfe eines MTT-Proliferationsassays ermittelt werden.
Prinzip des colorimetrischen Assays (MTT-Assay)
Der MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium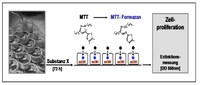
Siehe Abbildung links oben.
Prinzip des fluorimetrischen Zellproliferation und Zytotoxizitätsnachweis Assays (SYTOX® Green-Assay)
SYTOX® Green ist ein DNA-bindender Fluoreszenzfarbstoff, der nur in Zellen mit geschädigter Zellmembran, nicht aber in lebende Zellen mit intakter Zellmembran, einzudringen vermag. Aufgrund dieser Eigenschaften kann sowohl die Anzahl der lebenden wie auch der toten Zellen in einem Assay bestimmt werden.
Nach Inkubation der adhärenten Zellen oder Zellen in Suspensionskultur mit SYTOX® Green permeiert dieser Farbstoff zunächst ausschließlich in die toten bzw. geschädigten Zellen und bindet intrazellulär an die DNA. Der Intensität des gebildeten Farbstoff/DNA-Komplexes kann anschließend fluorimetrisch (Ex 485nm/Em 538nm) im Multiplatten-Reader gemessen werden. Die nachfolgende Lyse der Zellen mit einem Detergenz (z.B. Triton-X100) macht den Farbstoff für alle Zellen zugänglich, sodass nun der Anteil der lebenden Zellen erfasst wird. Die Bildung dieser DNA/Fluoreszenzfarbstoff-Komplexe ist direkt proportional zu der Anzahl der proliferierenden Zellen. Auch in diesem Assay wird eine Eichkurve erstellt und den gemessenen Fluoreszenz-Werten eine Zellzahl zugeordnet. Der Vorteil dieses Assays liegt in der hohen Sensitivität und der schnellen und simultanen Quantifizierbarkeit von Zellproliferation und Zytotoxizität.
Versuchsauswertung
- Entsprechend der vorher erstellten Eichgerade z.B. für intestinale Zellen wird den Messwerten (Extinktion oder Fluoreszenz) eine Zellzahl zugeordnet (Abbildung links)
- Im Falle einer konzentrationsabhängigen Inkubation werden die Zellzahlen gegen die Konzentration aufgetragen (Abbildung rechts):
Siehe Abbildung rechts oben.
Kosten (kolorimetrischer Nachweis)
- Ca. 10 € pro 96-well-Platte
Kosten (fluorimetrischer Nachweis)
- Ca. 25 € pro 96-well-Platte
Anwendungsbeispiele
Einfluss von Nahrungsinhaltsstoffen (sekundäre Pflanzeninhaltsstoffe, Vitamine und Oligosaccharide) auf fehlgesteuerte Prozesse der Kolonkarzinogenese (Hyperproliferation) und Morphogenese sowie Zytotoxizitätsuntersuchungen von Nahrungsinhaltsstoffen wie Pflanzenextrakte und Flavonoide (Kuntz et al. 1999, Wenzel et al. 2004) und Milcholigosaccharide und Glycotoxinen (Kuntz et al. 2007 and 2009 )
Referenzen
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65(1-2): 55-63.
- Kuntz S, Wenzel U, Daniel H. Comparative analysis of the effects of flavonoids on proliferation, cytotoxicity, and apoptosis in human colon cancer cell lines. Eur J Nutr. 1999;38(3):133-42.
- Wenzel U, Nickel A, Kuntz S, Daniel H. Ascorbic acid suppresses drug-induced apoptosis in human colon cancer cells by scavenging mitochondrial superoxide anions. Carcinogenesis. 2004;25(5):703-12.
- Kuntz S, Rudloff S, Kunz C. Oligosaccharides from human milk influence growth-related characteristics of intestinally transformed and non-transformed intestinal cells. Br J Nutr. 2007;10:1-10.
- Kuntz S, Rudloff S, Ehl J, Bretzel RG, Kunz C.Food derived carbonyl compounds affect basal and stimulated secretion of interleukin-6 and -8 in Caco-2 cells. Eur J Nutr. 2009 Jun 21. [Epub ahead of print]
