AG Tikkanen
Doktorandenstelle (Human- oder Zahnmedizin) für WS22/23 zu vergeben!
Bitte Prof. Tikkanen per Email kontaktieren!
AG Tikkanen entwickelt Enzymersatz-Therapie für eine seltene Erkrankung. Pressemitteilung
AG Tikkanen entdeckt neue Mechanismen bei der Therapie von Autoimmun-Dermatosen. PDF
Bildrechte: privat
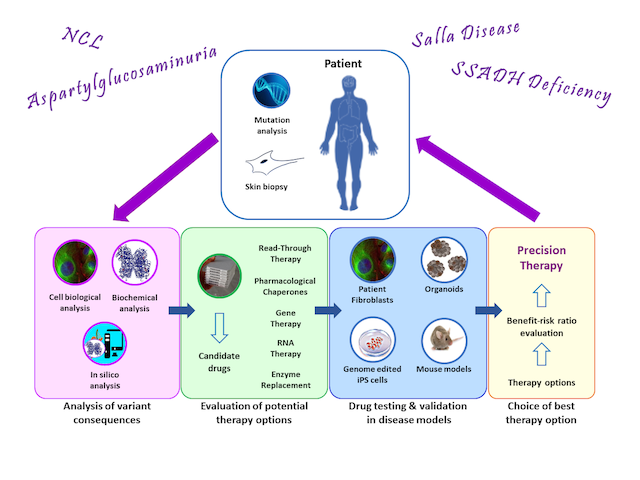
Forschungsgruppe seltene genetische Erkrankungen
Das Hauptforschungsinteresse unserer Gruppe gilt den molekularen Mechanismen seltener genetischer Erkrankungen und der Entwicklung personalisierter Therapien für solche Krankheiten. Das Spektrum der Krankheiten in unserem Forschungsschwerpunkt umfasst lysosomale Speicherkrankheiten (Aspartylglukosaminurie, neuronale Ceroid-Lipofuszinosen), Störungen des Neurotransmitter-Stoffwechsels (SSADH-Mangel) und Autoimmunerkrankungen (Pemphigus vulgaris). Darüber hinaus interessieren wir uns für die molekularen Mechanismen von Krebserkrankungen und die Rolle der Flotillin-Proteine beim Krebs.
Pressemitteilung (21.10.2021): Neuer Therapieansatz für genetische Erkrankungen
Aspartylglukosaminurie (R. Tikkanen und A. Banning)
Aspartylglukosaminurie (AGU) ist eine seltene genetische Störung, die durch Mutationen in dem Gen verursacht wird, das für das lysosomale Enzym Aspartylglukosaminidase (AGA) kodiert. AGU-Patienten kommen scheinbar gesund auf die Welt, beginnen jedoch in den ersten Lebensjahren, in ihrer Entwicklung zurückzubleiben, und werden bis zum frühen Erwachsenenalter zunehmend behindert und intellektuell beeinträchtigt. Derzeit gibt es keine zugelassenen Therapien für AGU.
Unsere Gruppe konzentriert sich auf die Charakterisierung der molekularen Folgen der AGU-Mutationen, mit dem Ziel, individuelle Therapien für AGU zu entwickeln. Unsere Ansätze umfassen pharmakologische Chaperone (PC), Nonsense-Read-Through-Medikamente, Korrektur von Spleißdefekten und Gentherapie. Bislang haben wir zwei PC-Therapien entwickelt (Banning et al. 2016). Eine von Prof. Tikkanen initiierte klinische Studie mit einer dieser Substanzen (https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-000645-48/FI) wird derzeit in Finnland gemeinsam mit Dr. Minna Laine, einer Kinderneurologin an der Universität Helsinki, durchgeführt. Für Patienten, die Nonsense-Mutationen in Kombination mit bestimmten Missense-Mutationen aufweisen, haben wir gezeigt, dass Substanzen, die den Nonsense-vermittelten Zerfall der mRNA hemmen und ein translationales Überlesen des Nonsense-Codons induzieren zu einer erhöhten Enzymaktivität in den Patientenzellen führen (Banning et al. 2018). Eine dieser Substanzen wurde auch in einer klinischen Studie getestet. Darüber hinaus entwickeln wir eine Behandlung mit kleinen Molekülen für Genvarianten, die zu einem mangelhaften Spleißen der mRNA führen (Banning et al. 2021).
Ein Gentherapieansatz für AGU wird derzeit in Zusammenarbeit mit UTSW-Forschern, insbesondere Dr. Steven Gray, und einem US-Unternehmen entwickelt (siehe: https://www.utsouthwestern.edu/labs/gray/). Die Gentherapie wurde vor kurzem an einem AGU-Mausmodell getestet, wobei sich Hinweise auf eine klinische Wirksamkeit ergaben (Chen et al. 2021).
SSADH-Mangel (R. Tikkanen und M. Didiasova)
Succinyl-Semialdehyd-Dehydrogenase (SSADH) ist ein mitochondriales Enzym, das am Abbau des Neurotransmitters GABA beteiligt ist. SSADH-Mangel (SSADH-D) ist eine genetische Störung, die durch Mutationen in dem Gen verursacht wird, das für das SSADH-Enzym kodiert. Fehlt die SSADH-Aktivität, reichern sich GABA und sein Metabolit GHB in den Geweben an und verursachen hauptsächlich neuronale und muskuläre Defizite. Unser derzeitiges Forschungsinteresse gilt der Charakterisierung der molekularen Folgen von SSADH-Mutationen und der Prüfung verschiedener Therapieoptionen in Zellkulturmodellen (siehe Didiasova et al. 2020, Brennenstuhl et al. 2020). Wie bei AGU und NCL sind wir daran interessiert, PC-Substanzen zu identifizieren, die die fehlende SSADH-Aktivität wiederherstellen würden, und nach Read-Through-Therapien zu suchen. Darüber hinaus entwickeln wir Strategien, die sich für eine Enzymersatz-Therapie und eine Gentherapie für SSADH-D eignen.
Neuronale Ceroid-Lipofuszinosen (R. Tikkanen)
Neuronale Ceroid-Lipofuszinosen (NCL) sind eine Gruppe von lysosomalen Speicherkrankheiten, die zu einer schweren Entwicklungsverzögerung führen, die mit Sehverlust und schwer kontrollierbaren epileptischen Anfällen einhergeht. Abhängig vom jeweiligen Gendefekt zeigen diese Krankheiten ein unterschiedliches Alter des Ausbruchs und des Krankheitsverlaufs und werden in verschiedene Formen (CLN1 - CLN14) eingeteilt. Unsere Gruppe interessiert sich für die klassischen spätinfantilen (cLINCL, CLN2, CLN5) und juvenilen (JNCL, CLN3) Formen. Therapien sind derzeit nur für wenige NCL-Formen verfügbar.
Wir haben bereits gezeigt, dass bestimmte Membranlipide, die sogenannten Ganglioside, bei JNCL in veränderten Mengen vorliegen (Somogyi et al. 2018). Insbesondere das Gangliosid GM3 akkumuliert in hohen Mengen, während andere Ganglioside wie GM1 reduziert sind. Da ausgewogene Mengen verschiedener Ganglioside für eine normale Gehirnentwicklung wichtig sind, testen wir derzeit, ob eine Modulation der Gangliosidmengen in NCLs einen therapeutischen Effekt haben könnte.
Auch bei NCL-Erkrankungen sind wir an der Entwicklung von Therapien interessiert, die auf ähnlichen Strategien beruhen, wie sie oben für AGU beschrieben wurden, nämlich Read-Through-Therapien und pharmakologische Chaperone. Da bestimmte Nonsense-Mutationen insbesondere bei cLINCL-Patienten sehr häufig vorkommen, könnte der Read-Through-Ansatz eine Möglichkeit bieten, eine große Zahl von Patienten mit demselben Medikament zu behandeln. Darüber hinaus könnten Substanzen, die das Spleißen beeinflussen, auch eine mögliche Therapieoption für eine der häufigsten cLINCL-Genvarianten darstellen (Banning et al. 2021). Darüber hinaus sind wir an einem industriegetriebenen Gentherapieprojekt für CLN5 beteiligt.
Bildrechte: privat
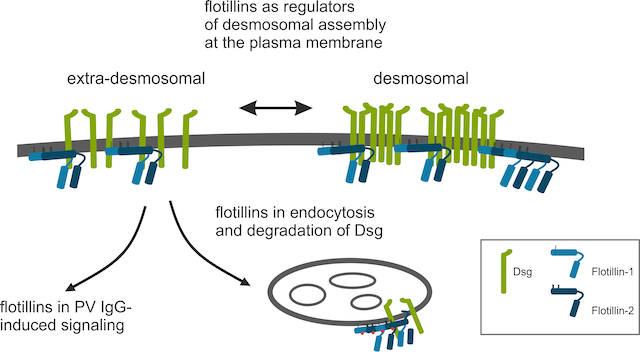
Funktion von Flotillin-Proteinen bei der Zelladhäsion: Molekulare Mechanismen bei Pemphigus Vulgaris (R. Tikkanen, A. Banning und A. Zakrzewicz)
Unsere aktuelle Arbeit umfasst die Charakterisierung der molekularen Funktion der Flotillin-Proteinfamilie. Ursprünglich wurden Flotilline als neuronale Regenerationsproteine beschrieben, die in den sich regenerierenden Axonen der retinalen Ganglienzellen hochreguliert werden und daher "Reggies" für Regeneration genannt werden. Spätere Studien haben gezeigt, dass Flotilline ubiquitär exprimiert werden, hoch konserviert sind und mit bestimmten Membranmikrodomänen assoziiert sind. Unsere bisherigen Arbeiten konzentrierten sich auf die Charakterisierung der Flotillin-Funktion bei der Signaltransduktion und Zelladhäsion. Wir haben gezeigt, dass Flotilline sowohl an der Zell-Matrix- als auch an der Zell-Zell-Adhäsion beteiligt sind (Banning et al. 2018, Völlner et al. 2016). Wir konnten zeigen, dass Flotilline an der Regulierung der desmosomalen Adhäsion in der Epidermis beteiligt sind und mit den desmosomalen Cadherin-Proteinen und Plakoglobin interagieren (Völlner et al. 2016).
Unsere aktuelle Forschung konzentriert sich auf die Aufklärung des molekularen Mechanismus, wie die desmosomale Adhäsion durch Flotilline reguliert wird, und wie Flotilline die desmosomale Adhäsion bei der schweren Autoimmunerkrankung Pemphigus vulgaris (PV) modulieren. Bei PV verursachen Autoantikörper gegen desmosomale Adhäsionsproteine, hauptsächlich Desmoglein-3, eine schwere Blasenbildung der Epidermis und der Schleimhäute aufgrund des Verlusts der desmosomalen Adhäsion in epidermalen Keratinozyten. Die Mechanismen des Adhäsionsverlustes sind noch nicht vollständig geklärt, aber wahrscheinlich spielen Signalübertragung und Vesikeltransport eine Rolle. Es ist bekannt, dass Flotilline sowohl an der Signalübertragung als auch am Membrantransport-Prozessen beteiligt sind, und wir untersuchen derzeit, wie Flotilline diese Prozesse im Zusammenhang mit Pemphigus modulieren. Wir sind Mitglied im DFG-geförderten Forschungsschwerpunkt FOR 2497 "Pemphigus - von der Pathogenese zur Therapie (Pegasus)" (www.pegasus-dfg.de). Neben ihrer Rolle bei der Regulation von Desmosomen in der Epidermis interessieren wir uns auch dafür, wie Flotilline die desmosomale Adhäsion im Herzgewebe beeinflussen (Kessler et al. 2018).
Flotilline bei Krebserkrankungen und als Regulatoren der MAP-Kinase-Signalkaskade (R. Tikkanen)
Unsere Ergebnisse zeigen, dass das Fehlen von Flotillin-1 zu einer starken Beeinträchtigung der EGF-Rezeptor-Signalübertragung führt. Nicht nur die Aktivierung des EGF-Rezeptors, sondern auch die nachgeschaltete Signalübertragung der MAP-Kinase-Kaskade wird gehemmt (Amaddii et al. 2012). Wir konnten zeigen, dass Flotillin-1 direkt mit mehreren Proteinen des MAP-Kinase-Wegs interagiert, darunter CRAF, MEK1 und ERK2, und somit höchstwahrscheinlich bei der Regulation der Signalübertragung auf Ebene der MAPK-Signalosomen fungiert. Flotilline werden bei verschiedenen Krebsarten überexprimiert, und unsere Forschung zielt darauf ab, die Verbindung zwischen der Flotillin-Funktion und der Krebs-/Metastasenbildung zu charakterisieren. Darüber hinaus ist Flotillin-1 an der endosomalen Sortierung von Transmembranproteinen, wie dem EGF-Rezeptor, beteiligt und interagiert mit endosomalen Sortierproteinen wie den ESCRT-Komplexen (Meister et al. 2017).
Our Funding
We gratefully acknowledge the support of following foundations and organizations:
German Research Council DFG Research Focus FOR 2497: http://gepris.dfg.de/gepris/projekt/289113135
Rare Trait Hope Fund: https://www.raretrait.com/home_1
Suomen AGU r.y.: http://www.aguyhdistys.com/p/etusivu.html
Jane ja Aatos Erkon Säätiö: https://jaes.fi/
SSADH-Defizit: https://ssadh.de/
SSADH Association: http://www.ssadh.net/site/c.ahJMLVMwGcK0E/b.8193477/k.B3DA/SSADH_Association.htm
In addition, we have several cooperation projects with the industry, as we are devoted to developing therapies for rare diseases!
Recent Publications (selection)
- Banning A, Tikkanen R (2021). Towards splicing therapy for lysosomal storage disorders: methylxanthines and luteolin ameliorate splicing defects in aspartylglucosaminuria and classic late infantile neuronal ceroid lipofuscinosis. Cells, 10, 2813; doi:103390/cells10112813
- Chen X, Snanoudj-Verber S, Pollard L, Hu Y, Cathey SS, Tikkanen R, Gray SJ. (2021) Preclinical Gene Therapy with AAV9/AGA in Aspartylglucosaminuria Mice Provides Evidence for Clinical Translation. Mol Ther, 29(3):989-1000. DOI: 10.1016/j.ymthe.2020.11.012
- Brennenstuhl H, Didiasova M, Assmann B, Bertoldi M, Molla G, Jung-Klawitter S, Hübschmann OK, Schröter J, Opladen T, Tikkanen R. (2020) Succinic Semialdehyde Dehydrogenase Deficiency: in vitro and in silico characterization of a novel pathogenic missense variant and analysis of the mutational spectrum of ALDH5A1. Int J Mol Sci, 21, 8578; doi:10.3390/ijms21228578
- Didiasova M, Banning A, Brennenstuhl H, Jung-Klawitter S, Cinquemani C, Opladen T, Tikkanen R. (2020)Succinic Semialdehyde Dehydrogenase Deficiency: an Update. (Review), Cells, 9(2). pii: E477. doi: 10.3390/cells9020477.
- Sairanen V, Tokola A, Tikkanen R, Laine M, Autti T. (2020) Statistical permutation test reveals progressive and region-specific iron accumulation in the thalami of children with aspartylglucosaminuria. Brain Sci, 10, 0677; doi:10.3390/brainsci10100677.
- Beckert B, Panico F, Pollmann R, Eming R, Banning A, Tikkanen R (2019) Immortalized human hTert/KER-CT keratinocytes as a model system for research on desmosomal adhesion and pathogenesis of Pemphigus Vulgaris, Int J Mol Sci, 20, 3113; doi:10.3390/ijms20133113
- Kessler EA, van Stuijvenberg L, van Bavel JJA, van Bennekom J, Zwartsen A, Rivaud MA, Vink A, Efimov IA, van Tintelen JP, Remme CA, Marc A. Vos MA, Banning A, de Boer TP, Tikkanen R, van Veen TAB. (2019)Flotillins in the intercalated disc are potential modulators of cardiac excitability. J Mol Cell Cardiol, 126:86-95. doi: 10.1016/j.yjmcc.2018.11.007
- Harjunen EL, Laine M, Tikkanen R, Helenius P (2019) Detailed Profile of Cognitive Dysfunction in Children with Aspartylglucosaminuria, J Inh Metab Dis, DOI: 10.1002/jimd.12159
- Tokola AM, Laine M, Tikkanen R, Autti TH (2019) Susceptibility-Weighted Imaging Findings in Aspartylglucosaminuria, Am J Neuroradiol, http://dx.doi.org/10.3174/ajnr.A6288
- Somogyi A, Petcherski A, Beckert B, Huebecker M, Priestman DA, Banning A, Cotman SL, Platt FM, Ruonala MO, Tikkanen R. (2018) Altered expression of ganglioside metabolizing enzymes results in GM3 ganglioside accumulation in cerebellar cells of a mouse model of juvenile neuronal ceroid lipofuscinosis. Int J Mol Sci, 19, 625; doi:10.3390/ijms19020625
- Banning A, Schiff M, Tikkanen R. (2018) Amlexanox Provides a Potential Therapy for Nonsense Mutations in the Lysosomal Storage Disorder Aspartylglucosaminuria. BBA - Molecular Basis of Disease, pii: S0925-4439(17)30463-5. doi: 10.1016/j.bbadis.2017.12.014
- Banning A, Babuke T, Kurrle N, Meister M, Ruonala MO, Tikkanen R. (2018) Flotillins regulate focal adhesions by interacting with α-actinin and by influencing the activation of Focal Adhesion Kinase. Cells, 7, 28; doi:10.3390/cells7040028
- Meister M, Baenfer S, Gärtner U, Koskimies J, Amaddii M, Jacob R, Tikkanen R. (2017) Regulation of cargo transfer between ESCRT-0 and ESCRT-I complexes by flotillin-1 during endosomal sorting of ubiquitinated cargo. Oncogenesis, 6, e344; doi:10.1038/oncsis.2017.47
- Banning A, König JF, Gray SJ, Tikkanen R. (2017) Functional Analysis of the Ser149/Thr149 Variants of Human Aspartylglucosaminidase and Optimization of the Coding Sequence for Protein Production. Int J Mol Sci, 18, 706; doi:10.3390/ijms18040706
- Banning A, Gülec C, Rouvinen J, Gray SJ, Tikkanen R. (2016) Identification of Small Molecule Compounds for Pharmacological Chaperone Therapy of Aspartylglucosaminuria. Sci Rep, 6, 37583; doi: 10.1038/srep37583
- Völlner F, Ali J, Kurrle N, Exner Y, Eming R, Hertl M, Banning A, Tikkanen R. (2016) Loss of flotillin expression results in weakened desmosomal adhesion and Pemphigus vulgaris-like localisation of desmoglein-3 in human keratinocytes. Sci Rep, 6, 28820; DOI:10.1038/srep28820
- Kapahnke M, Banning A, Tikkanen R. (2016) Random splicing of several exons caused by a single base change in the target exon of CRISPR/Cas9 mediated gene knockout. Cells 5, 45; doi:10.3390/cells5040045
- Banning A, Regenbrecht CRA, Tikkanen R. (2014) Increased activity of mitogen activated protein kinase pathway in flotillin-2 knockout mouse. Cell Signal, 26(2), 198-207. doi: 10.1016/j.cellsig.2013.11.001
- 18. Mooz J, Oberoi-Khanuja TK, Harms GS, Wang W, Tikkanen R, Jaiswal BS, Seshagiri S, Rajalingam K. (2014)Dimerization of ARAF promotes MAPK activation and cell migration. Science Signaling, 7(337):ra73. doi: 10.1126/scisignal.2005484
- Fork C, Hitzel J, Nichols BJ, Tikkanen R, Brandes RP. (2014) Flotillin-1 facilitates Toll-like receptor 3 signaling in human endothelial cells. Basic Res Cardiol, 109:439. doi: 10.1007/s00395-014-0439-4
Bitte finden Sie die komplette Publikationsliste der AG Tikkanen hier: Pubmed.
Sind Sie an einer Mitarbeit in unserer AG interessiert? Schicken Sie eine E-Mail mit Ihrem Lebenslauf an Prof. Tikkanen!
Medizinstudenten: Bitte erkundigen Sie sich nach freien Stellen für Doktorarbeiten!
Diplom-/Masterstudenten sind in unserem dynamischen Team herzlich willkommen!
Doktorandenkandidaten: Bitte wenden Sie sich direkt an Prof. Tikkanen!
