W-Elemente
Bioinformatische Analyse Weibchen-spezifischer, repetitiver Sequenzen
Außergewöhnlich innerhalb des Stamms Plathelminthes ist die Gattung Schistosoma, die Spezies umfasst, welche einen Geschlechtsdimorphismus im Adultstadium aufweisen. Schon lange ist es von großem Interesse, Weibchen-spezifische Sequenzen zu detektieren und ihre Funktion zu analysieren1-3. Genetisch betrachtet unterscheiden sich die Geschlechter u.a. im Karyotyp, Weibchen besitzen je ein W-, und ein Z-Chromosom, Männchen hingegen zwei Z-Chromosomen. Weite Teile der Z- und W-Chromosomen sind identisch. Jedoch befindet sich ein großer heterochromatischer Bereiche auf dem W-Chromosom, der so auf dem Z-Chromosom nicht vorkommt und somit Weibchen-spezifisch ist. In früheren Studien wurden repetitive Sequenzen in S. mansoni im heterochromatischen Bereich des W-Chromosoms detektiert und als Weibchen-spezifisch auftretende W-Elemente deklariert1-3. Spätere Studien belegten jedoch, dass diese W-Elemente auch in Männchen vorkommen können. Dies legte die Vermutung illegitimer Rekombinationsvorgänge nahe4,5. Weiterhin wurde die Möglichkeit diskutiert, dass diese Sequenzen transkribiert werden können6, einen mobilen, Transposon-ähnlichen Charakter aufweisen7 und an der Evolution der Geschlechtschromosomen beteiligt sind8.
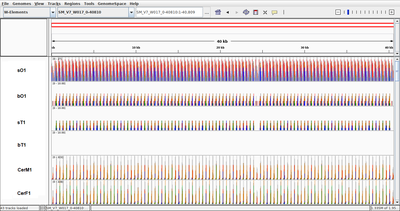
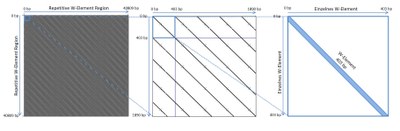
In diesem Projekt wollen wir dem Phänomen mobiler W-Elemente weiter auf die Spur kommen. Hierzu werden W-Elemente im Rahmen von Genom- und Transkriptomanalysen bioinformatisch analysiert9-12. Ziel ist, diese W-Elemente hinsichtlich ihrer Gruppenzugehörigkeiten, ihrer Aktivitäten in verschiedenen Stadien des Lebenszyklus von S. mansoni (Fig. 1) sowie zusätzlich auf struktureller Basis (Fig. 2) näher zu charakterisieren, um Hinweise auf ihr mobiles Verhalten und ihre mögliche Funktion zu bekommen.
1Spotila LD, Rekosh DM, Boucher JM, LoVerde PT (1987) A cloned DNA probe identifies the sex of Schistosoma mansoni cercariae. Molecular and Biochemical Parasitology 26:17–20. doi:10.1016/0166-6851(87)90125-3
2Webster P, Mansour TE, Bieber D (1989) Isolation of a female-specific, highly repeated Schistosoma mansoni DNA probe and its use in an assay of cercarial sex. Molecular and Biochemical Parasitology 36:217–222. doi:10.1016/0166-6851(89)90169-2
3Drew AC, Brindley PJ (1995) Female-specific sequences isolated from Schistosoma mansoni by representational difference analysis. Molecular and Biochemical Parasitology 71:173–181. doi:10.1016/0166-6851(95)00048-6
4Grevelding CG (1995) The female-specific W1 sequence of the Puerto Rican strain of Schistosoma mansoni occurs in both genders of a Liberian strain. Molecular and Biochemical Parasitology 71:269–272. doi:10.1016/0166-6851(94)00058-u
5Quack T, Doenhoff M, Kunz W, Grevelding CG (1998) Schistosoma mansoni; The varying occurrence of repetitive elements in different strains shows sex-specific polymorphisms. Experimental Parasitology 89:222–227. doi:10.1006/expr.1998.4293
6Fitzpatrick JM, Johnston DA, Williams GW, Williams DJ, Freeman TC, Dunne DW, Hoffmann KF (2005) An oligonucleotide microarray for transcriptome analysis of Schistosoma mansoni and its application/use to investigate gender-associated gene expression. Molecular and Biochemical Parasitology 141:1–13. doi:10.1016/j.molbiopara.2005.01.007
7Grevelding CG (1999) Genomic instability in Schistosoma mansoni. MolBiochemParasitol 101(1-2): 207-216
8Lepesant JMJ, Cosseau C, Boissier J, Freitag M, Portela J, Climent D, Perrin C, Zerlotini A, Grunau C (2012) Chromatin structural changes around satellite repeats on the female sex chromosome in Schistosoma mansoni and their possible role in sex chromosome emergence. Genome Biology 13:R14. doi:10.1186/gb-2012-13-2-r14
9Lu Z, Sessler F, Holroyd N, Hahnel S, Quack T, Berriman M, Grevelding CG (2016) Schistosome sex matters; A deep view into gonad-specific and pairing-dependent transcriptomes reveals a complex gender interplay. Scientific Reports 6:31150 EP -. doi:10.1038/srep31150
10Picard MAL, Boissier J, Roquis D, Grunau C, Allienne J-F, Duval D, Toulza E, Arancibia N, Caffrey CR, Long T, Nidelet S, Rohmer M, Cosseau C (2016) Sex-biased transcriptome of Schistosoma mansoni; Host-parasite interaction, genetic determinants and epigenetic regulators are associated with sexual differentiation. PLoS Neglected Tropical Diseases 10:e0004930. doi:10.1371/journal.pntd.0004930
11Protasio AV, Tsai IJ, Babbage A, Nichol S, Hunt M, Aslett MA, Silva N de, Velarde GS, Anderson TJC, Clark RC, Davidson C, Dillon GP, Holroyd NE, LoVerde PT, Lloyd C, McQuillan J, Oliveira G, Otto TD, Parker-Manuel SJ, Quail MA, Wilson RA, Zerlotini A, Dunne DW, Berriman M (2012) A systematically improved high quality genome and transcriptome of the human blood fluke Schistosoma mansoni.PLoS Neglected Tropical Diseases 6:e1455. doi:10.1371/journal.pntd.0001455
12Wang B, Collins JJ, Newmark PA (2013) Functional genomic characterization of neoblast-like stem cells in larval Schistosoma mansoni. eLife 2:e00768. doi:10.7554/eLife.00768
13James T. Robinson, Helga Thorvaldsdóttir, Wendy Winckler, Mitchell Guttman, Eric S. Lander, Gad Getz, Jill P. Mesirov. Integrative Genomics Viewer. Nature Biotechnology 29, 24–26 (2011)
14Helga Thorvaldsdóttir, James T. Robinson, Jill P. Mesirov. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in Bioinformatics 14, 178-192 (2013).
15Krumsiek J, Arnold R, Rattei T. Gepard: A rapid and sensitive tool for creating dotplots on genome scale. Bioinformatics 2007; 23(8): 1026-8. PMID: 17309896