Hundestaupevirus
Informationen zum Hundestaupevirus
Informationen zum Hundestaupevirus (CDV)
Das Virus
Der Erreger der Hundestaupe (canine morbillivirus, alias canine distemper Virus, CDV) zählt zur Virusfamilie Paramyxoviridae, Genus Morbillivirus. Morbilliviren gehören zu den am leichtesten übertragbaren Viren mit einem zum Teil sehr breiten Wirstspektrum. Neben dem Hundestaupevirus zählen heute das humane Masernvirus (MV), das Cetacean Morbillivirus (Delphin morbilivirus, DMV), das feline Morbillivirus (FeMV), das phocine Morbillivirus (Seehundstaupevirus; PDV), das Rinderpestvirus (RPV) und das Virus der Pest der kleinen Wierderkäuer (peste des petit ruminants virus; PPRV) zu den Morbilliviren. Der Name Morbillivirus leitet sich vom Diminutiv des lateinischen Morbus (Krankheit) ab. Hiermit wird die Unterscheidung der Masern, als weniger dramatische Erkrankung, im Vergleich zu den drastischeren Menschenpocken deutlich. Das humane Masernvirus hat seinen Ursprung vermutlich im Rinderpestvirus. Die erste Beschreibung der Masern stammt vom Ende des ersten Jahrtausends (Rhazes von Baghdad ca. 850–932). Mit der europäischen Kolonialisierung gelangte das Masernvirus im 16. Jhd. nach Südamerika mit dramatischen Folgen für die naive Bevölkerung.
Die Virionen sind behüllt, polymorph und über 150 nm groß (Abb. 1). Auffällig ist das helikale Nukleokapsid, bestehend aus der viralen RNA und den Virusproteinen N (Nukleoprotein), P (Phosphoprotein) und L (RNA-Polymerase). Morbilliviren besitzen eine Virushülle, in welche die viralen Glykoproteine H (Hämagglutinin) und F (Fusionsprotein) eingelagert sind. Die Virushülle ist innen mit dem Matrixprotein (M) ausgekleidet.

Abb. 1: Paramyxoviren im Elektronenmikroskop (Negativkontrastierung, VP Viruspartikel (tw. defekt), NK Nukleokapsid)
Virionen sind in der Außenwelt nur wenig stabil, sodass bei der Übertragung direkte Kontakte im Vordergrund stehen. Aufgrund der hohen Infektiosität ist hierbei aber nur eine geringe Virusmenge erforderlich. Das Genom der Paramyxoviren besteht aus einer einzelsträngigen RNA in Negativstrang-Orientierung mit einer Länge von etwa 16 Kilobasen (Kb), die 6 offene Leseraster umfasst (Abb. 2).

Abb 2: Genomorganisation von Morbiliviren
Die Infektion der Zielzelle erfolgt bei Morbilliviren nach Bindung des H-Proteins an den zellulären Rezeptor. Die Fusion der Virushülle mit der Zellmembran wird durch das F-Protein vermittelt, welches zuvor proteolytisch in die Untereinheiten F1 und F2 gespalten werden muss. Die Replikation findet imZytoplasma statt. Die virale RNA-Polymerase synthetisiert ausgehend vom 3‘ Ende des Negativstranggenoms einzelne monocystronische mRNAs. Bedingt durch den Transkriptionsmechanismus entsteht ein Konzentrationsgradient der viralen mRNAs (von N nach L). Die viralen mRNAs werden in der Folge durch den zellulären Syntheseapparat in virale Proteine übersetzt. In Abhängigkeit von der synthetisierten Menge an N-Protein schaltet die virale RNA-Polymerase dann von Transkription zur Genomreplikation um. Virionen schnüren sich an der Plasmamembran ab (budding). Durch die Einlagerung der viralen Hüllproteine in die Zellmembran kann es zur Fusion benachbarter Zellen und zur typischen Entstehung von Synzytien kommen, die u.a. beim Nachweis der Viren in Zellkulturen von Bedeutung sind (Abb. 3).
Zelluläre Rezeptoren für Morbilliviren sind SLAM/F1 (signaling lymphocyte activation moelcule F1 (CD150)), welches sich vor allem auf der Oberfläche von Lymphozyten, Makrophagen und dendritischen Zellen befindet, und NECTIN4 (gezeigt für MV und RPV) auf Epithelzellen.
a) 

Abb 3: VeroDST Zellen infiziert mit CDV (a) bzw. nicht infiziert (b).
Hundestaupe
Synonyme: Carré-Krankheit; canine distemper (CD)
Geschichte und Verbreitung
Die Hundestaupe wurde erstmals von Antonio de Ulloa y de la Torre-Giral (1716–1795) in Süd-Amerika beschrieben. Von dort gelangte es nach Spanien (1761) und breitete sich in Europa aus. 1809 beschrieb Edward Jenner die Erkrankung bei Hunden in England. Hundestaupe entwickelte sich zu einer der bedeutendsten Infektionskrankheit bei Hunden im 19. und frühen 20. Jahrhundert. Die weite Verbreitung der Krankheit führte in Großbritannien 1923 zur Einrichtung einer Stiftung mit dem Ziel der Entwicklung von Impfstoffen (Field Distemper Fund). Frühe Versuche zur Identifizierung des Erregers hatte verschiedene Bakterien als mögliche Ursache Identifiziert. Die auf der Basis dieser Erreger entwickelten Vakzinen blieben naturgemäß wirkungslos. Der Viruscharakter des Erregers wurde 1905 von Henri Carré erkannt (Carrésche Krankheit). Im Ramen der durch den Field Distemper Fund geförderten Forschungsarbeiten gelang es Laidlaw und Dunkin 1926 diese Ergebnisse zu bestätigen und die Erkrankung in einem kontrollierten Laborexperiment zu reproduzieren. Dabei erkannten sie auch, dass Frettchen hoch empfänglich für Hundestaupe sind und sich als Infektionsmodell eignen. Basierend auf den Arbeiten wurde 1929 der erste kommerzielle Staupe Impfstoff „Wellcome’ Canine Distemper Prophylactic“ entwickelt. Die ersten Impfprotokolle sahen noch eine Erstimpfung mit inaktiviertem Virus vor, gefolgt von einer Auffrischung mit vermehrungsfähigem Virus, tlw. in Kombination mit einem Hyperimmunserum gegen Staupevirus. Heute haben sich Lebendvakzinen mit attenuiertem Hundestaupevirus durchgesetzt. Durch die verbreitete Anwendung dieser Impfstoffe gelang es in vielen Ländern, die Hundestaupe erfolgreich zurückzudrängen. Die Impfstoffentwicklung beim CDV wurde erfolgreich auf die Rinderpest übertragen. Nach konsequenter Impfung und Bekämpfung wird diese Krankheit 2011 offiziell als ausgelöscht betrachtet.
Im Gegensatz dazu ist das Hundestaupevirus heute weltweit verbreitet und hat ein breites Wirtsspektrum. Neben Kaniden (u.a. Hund, Wolf, Fuchs) sind hierzulande besonders Musteliden (Marder, Frettchen) und Procyoniden (Waschbären) betroffen. Außerdem können Großkatzen (Löwen, Tiger) und Meeressäuger erkranken. So sind Ausbrüche bei Löwen im Serengeti Nationalpark (1994) und bei Baikalrobben (Phoca sibirica,1987) dokumentiert. Eine folgenschwere Infektion bei Seehunden (Phoca vitulina, 1988) wurde durch ein eng verwandtes Virus (phocines Staupevirus, PDV) mit unklarer Herkunft ausgelöst. Der sibirische Tiger (Panthera tigris altaica) ist u.a durch Hundestaupe vom Aussterben bedroht.
2014 wurde ein Morbillivirus bei Katzen beschrieben, welches in Zusammenhang mit Nierenerkrankungen gebracht wird.
Pathogenese
die Infektion mit dem Hundestaupevirus zeichnet sich durch sehr unterschiedliche Verlaufsformen aus. Betroffen sein können sowohl der Respirations- und/oder Gastrointestinaltrakt als auch das ZNS. Die Mortalität variiert ebenfalls erheblich.
Die Übertragung des CDV erfolgt vor allem über Aerosole sowie oral durch direkten Kontakt. Infizierte Hunde scheiden das Virus ab etwa einer Woche nach der Infektion über alle Körpersekrete und -exkrete aus. Nach Aufnahme des Errgers erfolgt eine initiale Virusvermehrung im lymphatischen Gewebe des oberen Digestions- bzw. Respirationstrakts (Rachenring, Lymphknoten, Tonsillen). Danach kommt es zu einer ersten Virämie und zur Ausbreitung des Erregers in lymphatische Gewebe und Organe (u.a. Milz, Lymphknoten, Thymus, Lymphgewebe des Darmes, Kupffer-Sternzellen in der Leber). Nach Virusvermehrung im Lymphgewebe treten eine zweite zellassoziierte Virämie und nachfolgend die Infektion epithelialer Gewebe (u.a. Niere) auf. Der Verlauf der Erkrankung wird wesentlich durch die Immunantwort des Wirtes beeinflusst und reicht von klinisch inapparentem Verlauf bis zur tödlichen, multisystemischen Infektion. Häufig sind mildere Verläufe, bei denen das Virus teilweise nicht vollständig eliminiert wird und in unterschiedlichen Geweben (Auge, Haut (Pfoten), ZNS) persistiert.
Von besonderer Bedeutung bei der Staupe sind zentralnervöse Verlaufsformen. Hierbei kann zwischen akuter demyelinisierender Enzephalitis und chronischen Prozessen unterschieden werden.
Klinik und Pathologie
Der Krankheitsverlauf ist abhängig von Alter und Immunstatus des Patienten sowie der Virulenz und Infektionsdosis des Erregers. Besonders empfänglich sind Welpen nach Verlust der maternalen Immunität.
Viele Infektionen verlaufen subklinisch oder mild. Symptome wie Fieber, Augen-/Nasenausfluss und Husten treten nach einer Inkubationszeit von 3-6 Tagen auf. Den Kardinalsymptomen entsprechend lassen sich eine katarrhalische Form, eine Hautform und eine ZNS-Form unterscheiden. Bei der katarrhalischen Form sind besonders der Respirations- und/oder Gastrointestinaltrakt betroffen; entsprechend dominieren Rhinitis, Tracheo-Bronchitis bis zu interstitiellen Pneumonien, Tonsillitis und Gastro-Enteritis. Bakterielle Sekundärinfektionen resultieren aus der Schädigung der Schleimhäute und der immunsuppressiven Wirkung des CDV. Labordiagnostisch ist eine ausgeprägte Leukopenie/Lymphopenie typisch. Am Auge kann eine Konjunktivitis und Uveitis auftreten. Im Bereich der Haut kann es zur Ausbildung einer pustulösen Dermatitis (Staupeexanthem) kommen.
Zentralnervöse Symptome wie Verhaltensänderungen, Zittern, Lähmungen und Krampfanfälle (Myoklonien) können zusammen mit katarrhalischen Entzündungen auftreten und führen meist zum Tod des betroffenen Tieres. In seltenen Fällen treten die ZNS-Symptome erst Wochen bis Monate nach einer akuten katarrhalischen Infektion auf.

Abb. 4: Hyperkeratose Fussballen Waschbär (G.Wibbelt, IZW)
Rekonvaleszenten zeigen zum Teil bleibende Schäden (Staupe-Tick, Staupe-Gebiss bei Welpen). Seltene Manifestationen sind die sog. „old dog Enzephalitis”, eine chronisch fortschreitende Enzephalitis bei älteren Hunden, und die “hard pad disease” (Abb. 4) , eine Hyperkeratose an Nase und Pfoten.
Histologisch zeigt sich bei der katarrhalischen Form eine hochgradige Entzündung mit Bildung zytoplasmatischer Einschlusskörperchen. Die Staupe-Enzephalitis manifestiert sich meist als Leukoenzephalitis in der weißen Substanz, besonders des Kleinhirns. Dabei lassen sich herdförmig akute, subakute und chronische Veränderungen mit und ohne Entzündungszellen nachweisen.
Diagnostik
Direkter Virusnachweis
Hundestaupevirus lässt sich direkt aus Tupfermaterial (Konjunktival- oder Nasentupfer), Urin, EDTA-Blut oder post mortem aus Organproben in der Zellkultur anzüchten. Allerdings ist die Virusanzucht zeit- und arbeitsaufwändig. Für die Virusanzucht eignen sich genetisch modifizierte Zellen aus der afrikanischen grünen Meerkatze, die das canine SLAM Molekül (signalling lymphocytic activation molecule, CD150) als Rezeptor exprimieren (VeroDST-Zellen).
Gebräuchlich ist der Nachweis viraler Antigene in Abstrichen (z.B. Konjunktivaltupfer) mit Hilfe der Immunfluoreszenz. Das Verfahren ist schnell und preiswert, aber fehleranfällig und versagt bei subakuten und chronischen Erkrankungen. Post mortem kann der Nachweis mit hoher Zuverlässigkeit an Gewebeschnitten durchgeführt werden.
Methode der Wahl für die Diagnose der Staupeinfektion intra vitam ist der Nukleinsäurenachweis mittels reverse Transkriptase-Polymerasekettenreaktion (RT-PCR; Abb. 5), zum Teil in Kombination mit quantitativen Echtzeitverfahren (RT-qPCR; Abb. 6). Für den Nachweis eignen sich neben Tupferproben und Abstrichen auch Blutproben (EDTA-Blut), Liquor oder Blasenpunktat/Mittelstrahlurin. Dabei ist zu beachten, dass das Virus über einen längeren Zeitraum auch nach klinischer Gesundung ausgeschieden werden kann. Eine weitere Herausforderung ist die Unterscheidung von Impf- und Feldvirus; so kann bei geimpften Tieren das Impfvirus unter Umständen über Wochen mittels RT-PCR nachgewiesen werden. Eine Unterscheidung ist durch Sequenzierung der PCR-Produkte grundsätzlich möglich, sofern die Sequenz des in Frage kommenden Impfstammes bekannt ist.

Abb. 5: Konventionelle nested RT-PCR zum Nachweis von Staupevirusgenom. (M - Größenmarker, 1-6 1.Runde; 1'-6' 2.Runde; 1-3 +ve Proben, 4 -ve Probe, 5 Negativkontrolle, 6 Positivkontrolle)

Abb.6 Echtzeit PCR zum Nachweis von Staupevirusgenom (Standard-Verdünnungsreihe 1:1 - 10^6; B.Bank-Wolf)
Indirekter Erregernachweis
Der Nachweis antiviraler Antikörper kann z.B. durch den Serumneutralisationstest (SNT) erfolgen. Neben Blutserum eignet sich hierfür auch Liquor cerebrospinalis, der ohne Blutbeimengungen gewonnen wurde.
Der einmalige Nachweis von Antikörpern im Serum eines Patienten lässt i.d.R. keinen Rückschluss auf eine Staupeinfektion zu. Auch lassen sich Antikörper als Folge einer Impfung nicht von solchen unterscheiden, die durch eine Infektion hervorgerufen wurden. Ein Antikörpernachweis im Liquor bei ungestörter Blut-Hirn-Schranke hingegen deutet auf das Vorliegen einer Staupeenzephalitis hin.
Beim gesunden Tier kann der Antikörpernachweis zur Bestimmung des Immunschutzes herangezogen werden. Hierzu hat die StIKo Vet eine “Stellungnahme zur Impfung nach Antikörperbestimmung bei Hund und Katze” veröffentlicht.
Differenzialdiagnosen
Da das Krankheitbild sehr heterogen ist müssen differentialdiagnostisch zahlreiche Erkrankungen berücksichtigt werden. Dazu gehören u.a canine Adenovirusinfektionen (Hepatitis contagiosa canis, Tracheobronchitis), Parvovirose,Coronavirusinfektionen, Tollwut u.a..
Bekämpfung und Prophylaxe
Die Therapie erfolgt bei erkrankten Tieren symptomatisch (Expektoranzien, Elektrolytsubstitution, Antibiose, Antikonvulsiva). Insbesondere die zentralnervösen Symptome sind schwierig zu therapieren. Eine passive Immunisierung mit einem Hyperimmunglobulinpräparat kann versucht werden. Über die Erfolgsaussichten bestehen unterschiedliche Meinungen.
Im Vordergrund der Maßnahmen gegen die Hundestaupe steht die aktive Immunisierung von Hunden. Hierbei werden Impfstoffe eingesetzt, die auf vermehrungsfähigen, abgeschwächten Staupeviren basieren und meist mit anderen Impfantigenen kombiniert werden. Das Impfschema richtet sich nach den Angaben der Hersteller bzw. den Empfehlungen der StiKo Vet:
Grundimmunisierung:
1. Impfung 8. LW
2. Impfung 12. LW
3. Impfung 16. LW
4. Impfung 15. LM
Auffrischungsimpfung:
Wiederholungsimpfungen im Abstand von bis zu 3 Jahren
Die Impfung gegen Hundestaupe wird von der StiKo Vet als Core-Impfung eingestuft, die bei allen Hunden durchgeführt werden sollte.
Der Erfolg der flächendeckenden Impfung in Westeuropa hat zu einer nachlassenden Impfbereitschaft bei den Hundehaltern geführt. Ähnlich wie bei der humanen Masernvirusinfektion, hervorgerufen durch ein Virus aus der gleichen Familie, ist auch bei der Hundestaupe die sog. Herdenimmunität von großer Bedeutung, um insbesondere Jungtiere zu schützen. Vor dem Hintergrund einer Bedrohung der Hundepopulation durch Staupe bei Wildtieren (Füchsen und Waschbären) sowie Importen infizierter Hunde, ist eine Impfung von Hunden weiterhin empfehlenswert.
Desinfektion
Beim CDV handelt es sich um ein behülltes Virus, das einfach mit handelsüblichen Desinfektionsmitteln und Detergentien inaktiviert werden kann (s. Desinfektionsmittellisten der DVG, Bereich
Tierhaltung, http://www.desinfektion-dvg.de).
Staupe bei Wildtieren in Deutschland
Das Staupevirus hat ein sehr breites Wirtsspektrum. Bei der Untersuchung von Vewandtschaftsbeziehungen zwischen Virusisolaten fällt auf, dass Viren die von ganz unterschiedlichen Wirtstieren stammen z.T. eng verwandt sind (Abb. 7). Daraus kann geschlossen werden, dass eine Übertragung zwischen unterschiedlichen Tierarten vorkommt.
Abb. 7: Phylogentischer Baum basierend auf kompletten Sequenzen von CDV Isolaten
In Zusammenarbeit mit dem Leibniz Institut für Zoo- und Wildtierforschung und dem Landeslabor Berlin-Brandenburg wurden am Institut für Virologie in Gießen Proben von Wildtieren (Waschbären) aus dem Stadtgebiet Berlin untersucht. Es handelte sich dabei um den ersten dokumentierten Ausbruch von Staupe bei Procyoniden in Europa. Von 97 Waschbär-Totfunden konnte bei 74 eine Staupeinfektion bestätigt werden (Abb. 8-10). Die Analyse der Virusisolate zeigte eine Ähnlichkeit zu Virusstämmen bei Hunden aus Europa und legen eine Ansteckungsquelle in der Hundepopulation nahe. Die Möglichkeit einer Übertragung zwischen gehaltenen Hunden und Wildtieren stellt eine Gefahr für beide Seiten dar.

Abb. 8: Lunge Waschbär (Hämorrhagien und fehlende Retraktion; G. Wibbelt, IZW)
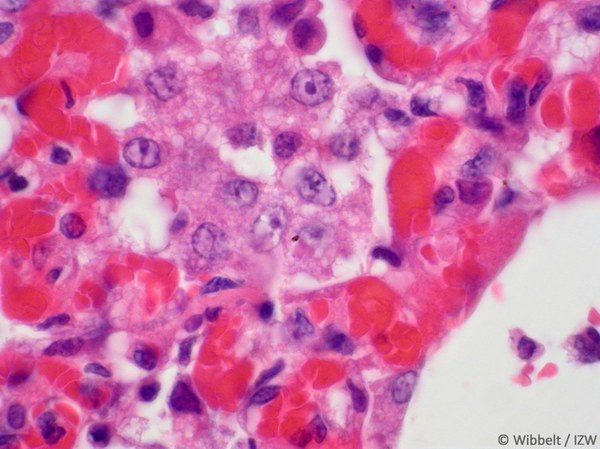
Abb. 9: Lunge Waschbär (gestaute Alveolarkapillaren mit Synzytiumbildung im Zentrum; G. Wibbelt, IZW)

Abb. 10: Rückenmark Waschbär (generalisierte mononukleäre Entzündungszellinfiltrate; G. Wibbelt, IZW)

