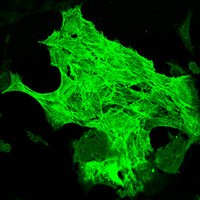
Forschungsschwerpunkte
Kardiovaskuläre Stammzellforschung
- Bedeutung mechanischer Zugbelastung und reaktiver Sauerstoff-Intermediate für die kardiomyogene Differenzierung embryonaler Stammzellen.
Embryonale Stammzellen differenzieren Herzgewebe innerhalb des dreidimensionalen Gewebes von Embryoid bodies. Die der Differenzierung unterliegenden Mechanismen sind bisher nicht bekannt. Versuche unserer Gruppe zeigen, dass die Differenzierung von Herzmuskel in Embryoid bodies einer zytomechanischen Kontrolle unterliegt, wie sie schon für die Herzentwicklung von Hühnchen-Embryonen in vivo beschrieben wurde. In weiteren Untersuchungen unserer Gruppe konnte gezeigt werden, dass bei experimenteller mechanischer Zugbelastung reaktive Sauerstoff-Intermediate im Gewebe erzeugt werden; zuvor war von uns berichtet worden, dass niedrige Konzentrationen an reaktiven Sauerstoff-Intermediaten die Kardiomyogenese embryonaler Stammzellen stimulieren. Daher sind möglicherweise reaktive Sauerstoff-Intermediate diejenigen sekundären Botenstoffe, welche nach Zugbelastung die Aktivierung kardialer Gene vermitteln.
Im vorliegenden Forschungsprojekt werden aus embryonalen Stammzellen der Maus und des Menschen gezüchtete Gewebe (Embryoid bodies) unterschiedlichen Zugebelastungs-Protokollen ausgesetzt und deren Einfluß auf die Kardiomyogenese untersucht. Von besonderem Interesse ist hierbei die Analyse der Genaktivierung früher kardialer Gene und Transkriptionsfaktoren nach statischem bzw. zyklischem mechanischem Stress. Einen weiteren Schwerpunkt dieses Forschungsprojektes bildet die Analyse der Generierung reaktiver Sauerstoff-Intermediate nach mechanischem Stress und deren Involvierung in Signalwege der Kardiomyogenese embryonaler Stammzellen.
- Bedeutung des Zytokins Cardiotrophin-1 (CT-1) für die Kardiomyogenese embryonaler Stammzellen.
Cardiotrophin-1 (CT-1) ist ein neues Zytokin der Interleukin-6 (IL-6) Familie und induziert in adulten Herzzellen hypertrophes Zellwachstum. Im Embryo dagegen fördert CT-1 die Proliferation von Herzzellen und inhibiert den apoptotischen Zelluntergang. CT-1 bindet an ein Heterodimer des Signaltransduktions-Rezeptor gp130 und des LIF-Rezeptors und aktiviert die Janus-Kinasen 1 und 2 (JAK1/2), die wiederum STAT1 und 3, sowie den Mitogen aktivierten Protein Kinase Weg (MAPK) stimulieren. Untersuchungen unserer Gruppe zeigen, dass CT-1 in Kardiomyozyten, die aus embryonalern Stammzellen differenziert worden waren, die Generierung reaktiver Sauerstoff-Intermediate induziert. Diese reaktiven Sauerstoff-Intermediate spielen eine Rolle als Signalmoleküle in der Signaltransduktionskaskade von CT-1 und steuern offensichtlich dessen Expression. Unser Forschungsprojekt soll die Bedeutung reaktiver Sauerstoff-Intermediate in der CT-1 vermittelten Signaltransduktion, die zur Stimulation der Herzzellproliferation führt, untersuchen. Da hypertrophes Herzwachstum auf einer Reaktivierung eines embryonalen Genexpressions-Programms beruht, werden Einsichten in die Entstehungsmechanismen der hypertrophen Herzkrankheit erwartet. Ferner soll die Untersuchung der CT-1-vermittelten Signalvorgänge Möglichkeiten eröffnen, aus embryonalen Stammzellen proliferatives Herzzellgewebe für Transplantationszwecke zu züchten. - Gefäßdifferenzierung Fett-abgeleiteter Stammzellen.
Seit wenigen Jahren ist bekannt, dass auch das Fettgewebe des Menschen Stammzellen enthält, die zur Gewebezucht geeignet sind. In der hiesigen Arbeitsgruppe wurden Protokolle zur Gefäßzell-Differenzierung multipotenter Fett-abgeleiteter Stammzellen erarbeitet. Diese Gefäßzellen werden in grundlagenwissenschaftlichen Experimenten eingesetzt, um einerseits in vitro gezüchtete avaskuläre Gewebe experimentell mit Blutgefäßen zu versorgen, auf der anderen Seite auch dazu, in Tiermodellen die Revaskularisierung ischämischer Gewebsbereiche zu erreichen. Die Arbeiten verfolgen das Ziel diese Zellen in der Zukunft beim Patienten zur Revaskularisierung ischämischer Infarktareale beim Herzinfarkt einzusetzen. Da Patienten-eigenes Gewebe zum Einsatz kommt sind hier keine Abstoßungsreaktionen durch das Immunsystem zu erwarten. - Die Rolle von Angiopoietin 1/2 und tie-2 während der Endothel-Glatte-Muskel Interaktion und glatte Muskel-Zellproliferation. Untersuchungen zur Vaskulogenese und glatte Muskel-Differenzierung embryonaler Stammzellen der Maus.
Im Embryoid body Modell embryonaler Stammzellen werden Gefäßstrukturen, begleitet von glatter Muskulatur, differenziert. Hierdurch ist dieses System in idealer Weise für die Untersuchung der glatte Muskel-Endothel-Interaktion während der Vaskulogenese und Angiogenese geeignet. In diesem Projekt werden die Auswirkungen einer experimentellen Modulation des Expressionsniveaus von Ang-1, Ang-2, VEGF-A und einer pharmakologischen und molekularen Inhibition VEGF-A- and Ang-1/2/tie-2-mediierter Signal-Transduktionswege auf die Serotonin-Sekretion, vaskuläres Wachstum und Gefäßreife sowie Differenzierung gefäßbegleitender glatter Muskulatur untersucht. Unter Nutzung der Tiefenauflösung konfokaler Laserraster-Mikroskopie werden Signalereignisse (z.B. Aktivierung von MAPK-Kaskaden, Calcium-Signale, Generierung reaktiver Sauerstoff-Intermediate) spezifisch in jeweils Endothel- oder glatten Muskelzellen untersucht. Unsere Untersuchungen evaluieren experimentelle Möglichkeiten die Proliferation glatter Muskelzellen an der Gefäßwand zu kontrollieren um hieraus klinische Strategien für die Behandlung von Lungenhochdruck und Arteriosklerose zu entwickeln.
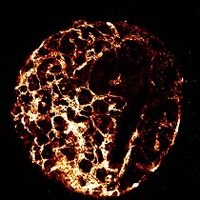
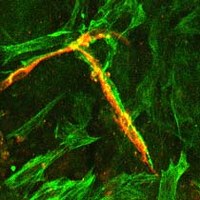
Blutgefäß-Differenzierung in Embryoid bodies aus embryonalen Stammzellen (links) und glatte Muskel (grün)-Gefäß (rot)-Interaktion während der Gefäßbildung (rechts).