Regulierung der Genunterdrückung an der Kernperipherie
Die Zellkernhülle ist ein spezialisiertes Subkompartiment, das die Bildung und Aufrechterhaltung von ‚silent‘ Chromatin fördert. Dies erfolgt durch die Rekrutierung von Chromatin und Komponenten der ‚Silencing-Maschinerie‘. Man vermutet, dass dies deren lokale Konzentration erhöht und auch zu der Spezifität der Reaktionen beiträgt.
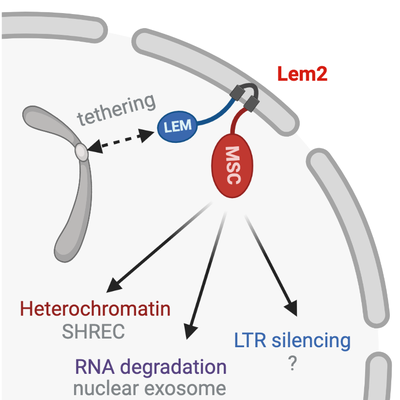
Wir konnten zeigen, dass das konservierte Kernmembranprotein Lem2 an Heterochromatin-Silencing und der perinukleären Lokalisierung von Zentromeren beteiligt ist. Diese Funktionen lassen mechanistisch voneinander trennen und werden von verschiedenen Proteindomänen von Lem2 vermittelt (Barrales et al. Genes Dev 2016). Darüber hinaus ist Lem2 RNA-Abbau (Martin Caballero et al., Nature SMB 2022) und Silencing von Retrotransposons beteiligt. Dies macht deutlich, dass Lem2 eine zentrale Rolle bei der Koordinierung verschiedener Zellkernfunktionen an der nukleären Peripherie spielt, sowohl auf transkriptioneller als auch post-transkriptioneller Ebene. Heterochromatin-Silencing wird vermittelt durch Rekrutierung eines Snf2-ähnlichen Nukleosom-Remodeller/Histon-Deacetylase Repressor-Komplex (SHREC, ein Homolog des NuRD-Komplexes aus Säugetieren), welches an die MSC-Domäne von Lem2 bindet. Analog hierzu wird RNA-Abbau gefördert durch die Rekrutierung des MTREC-Komplexes (Homolog des humanen PAXT-Komplexes). MTREC führt RNA-Moleküle dem nukleären Exosom zu (‚targeting‘), welches der Hauptabbauweg für RNAs innerhalb des Zellkerns in Eukaryoten ist. Auf welche Weise Lem2 Retrotransposon-Silencing vermittelt, ist derzeit noch nicht verstanden.