A3 - Glucosehomöostase beim Menschen
Titel: Glukosehomöostase beim Menschen
Projektleiter: T. Linn, R.G. Bretzel, C. Kunz
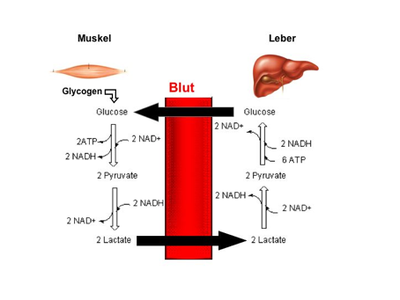
Bei akutem Nährstoffmangel gehört die Neubildung von Glukose (Glukoneogenese) in der Leber zu den wichtigsten Überlebensstrategien des menschlichen Körpers. Da die Leber die gebildete Glukose rasch in das Blut zur Verteilung an die lebenswichtigen Organe wie Gehirn, Herz und Nieren weiter gibt, wird bei anhaltendem Mangel Nachschub von geeigneten Stoffen aus körpereigenen Depots benötigt. Als geeigneter Kandidat gilt Laktat (Milchsäure) aus Muskelgewebe. Die Muskulatur bildet etwa die Hälfte der Körpermasse und gibt Laktat in das Blut ab, welches von der Leber zu Glukose verarbeitet wird (Abbildung 1, Cori-Zyklus). Da es jedoch noch eine Reihe weiterer potentieller Vorstufen für die Glukoneogenese gibt, ist die physiologische Bedeutung des Cori-Zyklus unklar.
Um den Laktatanteil an der Glukoneogenese genauer zu bestimmen, untersuchten wir die Laktatabgabe der Skelettmuskulatur des Vorderarms unter Einsatz des stabilen Isotops [13C]-Laktat. Weiterhin stellten wir die Frage, ob die Skelettmuskulatur im Glukosemangel bei hochnormalen Insulinspiegeln in der Lage ist, ihre Glukoseaufnahme anzupassen. Der akute Glukosemangel bei gleichzeitig hohem Insulinspiegel hat klinische Bedeutung bei Personen mit Diabetes unter Insulinbehandlung. Gefürchtet ist hier der insulininduzierte niedrige Blutzucker (Hypoglykämie), der ohne Gegenmaßnahmen zur Bewusstlosigkeit führt.
In unserer Versuchsanordnung (Abbildung 2) betrachteten wir die Substratkinetiken an der Vorderarmmuskulatur als repräsentativ für alle Muskeln. Bei Hypoglykämie stieg der Laktatumsatz kontinuierlich, was unter anderem messbar war an einer Zunahme der Laktatspiegel im arteriellen Blut. Die Glukoneogenese aus Laktat fand sich erhöht, ein deutlicher Hinweis für die Aktivität des Cori-Zyklus im Glukosemangel trotz vergleichsweise hoher plasmatischer Insulinkonzentrationen.
Der Beitrag der in die Zirkulation abgegebenen Laktatmenge, welcher in der Bilanz zu Glukose umgewandelt wird, errechnete sich zu fast 40% der gesamten Glukoneogenese. Ein weiterer wichtiger Beitrag des Muskelgewebes ist der Glukose-Spareffekt. Die Muskulatur ist in der Lage, ihren Glukoseverbrauch erheblich einzuschränken. Die Summe der Wirkungen aus Cori-Zyklus und Glukose-Spareffekt ergibt einen Anteil der Muskulatur von fast 90% an der adäquaten Reaktion des Organismus auf Glukosemangel (Abbildung 3). Damit leistet die Gesamtheit aller Muskeln einen deutlich grösseren Beitrag zur Kompensation des Glukosemangels als bisher angenommen. Ein wichtiger Mechanismus für diese Anpassungsleistung könnte aufgrund unserer Messungen die Verstärkung des Blutflusses im Bereich der Muskulatur sein.
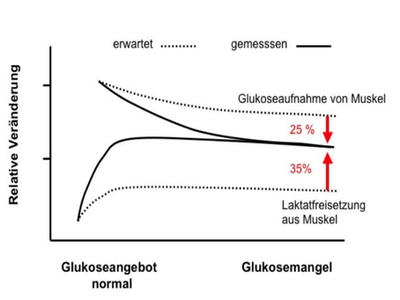
In der folgenden Abbildung 3 können Sie den geschätzten kombinierten Beitrag der Körpermuskulatur zur Reaktion des Organismus auf Glukosemangel erkennen. Aufgrund von Angaben aus der Literatur wurde nur ein geringer Anteil des Muskelgewebes an der Glukoneogenese aus Laktat erwartet. Tatsächlich fanden wir einen Beitrag von mehr als 35%. Auch die Anpassung des muskulären Glukosetransports war mit 25% leistungsfähiger als erwartet.
Weitere Informationen:
Klinische Forschungseinheit (CRU)
Medizinische Klinik und Poliklinik III
Institut für Ernährungswissenschaften
Publikation
Meyer C, Saar P, Soydan N, Eckhard M, Bretzel RG, Gerich J, Linn T.
A potential important role of skeletal muscle in human counterregulation of hypoglycemia.
J Clin Endocrinol Metab. 90:6244-6250, 2005 und 91:27, 2006
Dissertation Petra Saar
Hormonale und nicht-hormonale Mechanismen der Gegenregulation bei Hypoglykämie
